Researches研究内容
肝臓が薬物の主な解毒臓器である事を考えると、薬物の肝臓への取り込み、胆汁排泄機構を解明することの重要性は言うまでもない。当教室では既に種々のアニオン性、カチオン性化合物の肝への取り込みに能動輸送機構が関わる事を速度論的手法により明らかにしてきた。近年、げっ歯類やヒトにおいて一連のトランスポーターのクローニングが進められてきている。例えば、有機アニオン性化合物の輸送には、主にOATP(organic anion transporting polypeptide)ファミリーのトランスポーター、胆汁酸に関しては、主にNTCP(Na+-taurocholate cotransporting polypeptide)が、また有機カチオン化合物の輸送には、OCT(organic cation transporter)ファミリーがそれぞれ関与している(図3)。これらトランスポーターは、それぞれ非常に広範な基質特異性を有し、内因性の胆汁酸やステロイド抱合体、またプラバスタチンやメトトレキセートなど多種の薬物も基質にする。当研究室では、遺伝子発現哺乳類細胞を用いた各トランスポーターの機能解析、基質特異性の解析を行い、種々の薬物動態における各トランスポーターの寄与率を定量的に評価する方法論の構築、検討を進めている。近年では、ヒト凍結肝細胞を用いて、ヒトにおける肝臓の取り込みの検討も行えるようになった。また、評価法についても各トランスポーター特異的な阻害剤や基質を用いた方法のみならず、ノックアウトマウスやRNAi(RNA interference)法などを用いた遺伝子特異的ノックダウンによる検討も進めている。
また、有機アニオン系化合物の胆汁排泄機構にも、ATPの加水分解に直接共役した一次性能動輸送の関与が明らかとなっており、種々の実験系を用いた検討を行ってきた。当教室では、自然発生的に見出された高ビリルビン血症を示すラット(現在では、EHBR (Eisai Hyperbilirubinemic rat)と命名されている。)の原因として、MRP2 (multidrug resistance associated protein 2)遺伝子のナンセンス変異を見出し、この排泄輸送担体のcDNAクローニングにも成功をおさめ、細胞膜ベシクルなどを用いた機能解析、基質認識/輸送に関与するアミノ酸残基の同定等を進めてきた。なお、本遺伝子は、ヒトにおけるDubin-Johnson症候群の疾患遺伝子としても同定されており、現在ヒトMRP2に関しても同様の検討を進めている。本トランスポーターも取り込み側同様、非常に幅広く有機アニオンを認識し、薬物や内因性物質の胆汁排泄に重要な役割を果たしている。また、胆管側には他に有機カチオンや中性の化合物の輸送に関わる、P-gp(P-glycoprotein)、種々の胆汁酸を認識するBSEP(bile salt export pump)や、BCRP(breast cancer resistance protein)などが同定されており(図3)、特にBCRPは、当教室での検討により、種々の硫酸抱合体を特に良好な基質とすることから、今までに見出されなかった硫酸抱合体の排泄システムとして注目を集めており、ノックアウトマウスなどを用いたin vivoでの検討を進めている。
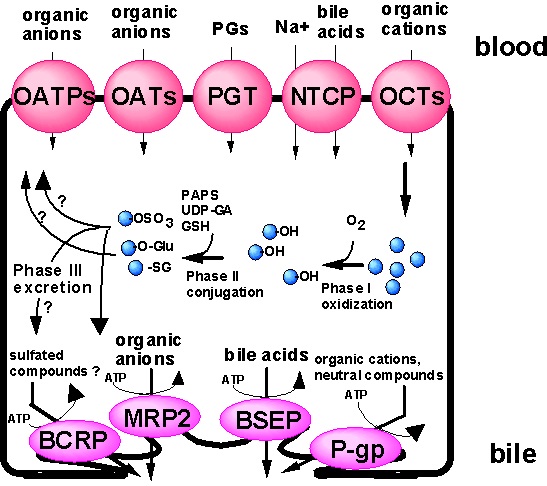
図3 肝臓に存在する排出輸送担体とその機能協関
